На некоторые товары неверно отображаются цены.
Уточняйте цены у менеджера.
Нативная мембрана из перикарда bioPLATE Barrier Fit обеспечивает надежные барьерные функции.
1.Благодаря своим физико-механическим свойствам удобна в применении;
2.Из-за высокой гидрофильности не всегда требует дополнительной фиксации;
3.Устойчива к разрыву;
4.Надежно удерживает граф даже небольшого объёма.
-
НКР (горизонтальная и вертикальная аугментация)
-
Реконструкция альвеолярного отростка
-
Стабилизация кровяного сгустка
-
Фиксация остеопластического трансплантата
-
Закрытие перфораций гайморовой пазухи
-
Закрытие прободаний нижне-челюстного канала
Частичная и полная потеря зубов, вызванная осложненными формами кариеса и заболеваниями пародонта, является наиболее часто встречаемой патологией зубочелюстной системы. Статистические данные показывают, что данной патологией страдает до 75% населения как нашей страны, так и других стран мира, включая страны с развитой экономикой.
Методы протезирования дефектов зубных рядов как с помощью съемных, так и с помощью несъемных протезов, опирающихся на собственные зубы, приводят к преждевременной потере опорных зубов, атрофии альвеолярных отростков и к другим нарушениям как зубочелюстной системы, так и организма в целом. Сегодня наиболее физиологический способ лечения потери зубов это изготовление ортопедических реставраций на искусственных опорах (дентальных имплантатах). Конечной целью всех этих мероприятий становится полноценная реабилитация пациентов с приобретенными дефектами зубных рядов. Несмотря на то, что по данным литературы «выживаемость» ортопедических конструкций на имплантах в первые 10 лет выше, чем на собственных зубах (90% против 80%), существует ряд проблем, связанных с осложнениями, наступающими вследствии дефицита объема и/или высоты гребня в зоне имплантации.
Одна из проблем, с чем сталкивается хирург-стоматолог при установке имплантатов, заключается в дефиците альвеолярной кости. Основными методами лечения данной патологии выступают способы, позволяющие увеличить объем костяной ткани в зоне имплантации. В конце 90-х годов ХХ века были описаны техники направленной тканевой регенерации, основанные на применении барьерных мембран. В физиологической основе этих методов лежит понимание того, что в процессе заживления раны участвуют разные типы клеток, регенерирующие с разной скоростью. Роль барьерной мембраны состоит в том, чтобы предупредить прорастание соединительной ткани в область, где происходит гистогенез высокодифференцированных тканей.
Актуальностью представленного исследования является то, что в доступной литературе еще мало экспериментальных данных об особенностях остеогенеза в зависимости от применяемых материалов и самих методик НКР. Есть сложности с оценкой степени и сроков дифференцировки состояния восстановленной костной ткани как в эксперименте, так и в клинических условиях. В специальной литературе мало сведений о характере и типе остеоинтеграции в зависимости от применяемого имплантата и качества остеогенной ткани. Большие сложности с клинической оценкой состояния параимплантатной костной ткани, а также сроков ее дифференцировки. Мало данных об особенностях и различиях в механизмах остеоинтеграции при непосредственной, отсроченной имплантации, а также имплантации проводимой одномоментно с НКР. Немногочисленны и противоречивы данные об остеоинтеграции при применении остеоиндуктивных биодеградирующих составов и барьерных мембран для направленного восстановления параимплантатных участков альвеолярной кости человека.
Степень разработанности темы исследования. На сегодняшний день cреди способов НКР заслуживают внимание способ, описанный I. Urban, который заключается в увеличении объема челюстной кости за счет применения смеси костнозамещающего материала и аутогенной стружки. Данный материал укладывается в зону дефекта, закрывается барьерной мембраной, края которой фиксируются металлическими пинами. Если ширина резидуальной кости не менее 5 мм, то имплантаты устанавливаются одномоментно, если ширина зубодесневого гребня уже 5 мм, то устанавливаются по отсроченному протоколу, спустя 8-9 месяцев после остеопластики. Основным недостатком способа считается применение металлических пинов, что требует на этапе установки формирователей десны широкого скелетирования поверхности кости для их удаления.
Эффективным способом операций остеорегенерации оказывается метод увеличения толщины костяного гребня с созданием поднадкостничного конвертного лоскута по М.Штайгману. Данная техника включает разрез слизистой оболочки по вершине альвеолярного отростка, формирование поднадкостничного кармана, заполнение кармана аутогенной костной стружкой, закрытие барьерной мембраной, подшивание барьера к надкостнице, фиксацию его крестообразным швом через надкостницу с расположением узла в полости рта с язычной стороны. Недостатком представляется выведение узла в полость рта, что повышает риск его несостоятельности и, как следствие, может привести к подвижности графта на ранних этапах созревания, а также невозможность одномоментного забора аутокостной стружки в области операции и проведения декортикации, что снижает скорость образования и качество аугментата.
Обобщая данные литературы, можно сделать заключение о том, что разработка изолирующих барьеров для НКР, обладающих самостоятельными остеопластическими свойствами, а также разработка новых стратегий направленной костяной аугментации и внедрение их в хирургическую практику является актуальной задачей современной стоматологии и дентальной имплантологии, что и определяет цель и задачи наших испытаний.
Цель исследования: Экспериментально-клиническое обоснование применения отечественной коллагеновой барьерной мембраны поколения «bioPlate Barier» для повышения эффективности и качества стоматологической реабилитации пациентов с различными формами частичной и полной потери зубов в условиях атрофии альвеолярного гребня.
Задачи исследования:
1. Изучить на экспериментальной модели на крупных животных (баранах) тканевой ответ на имплантацию «bioPlate Barier».
2. Оценить на экспериментальной модели эффективность методов направленной регенерации с применением барьерной мембраны «bioPlate Barier».
3. Оценить клиническую эффективность хирургической реконструкции челюсти с применением «bioPlate Barier».
4. Разработать практические рекомендации по использованию резорбируемой барьерной мембраны «bioPlate Barier» для направленных реставраций в стоматологической практике.
Научная новизна работы: Впервые в эксперименте на крупных животных cравнили эффективность «bioPlate Barier» с резорбируемыми мембранами отечественных и зарубежных производителей. Установлено, что «bioPlate Barier» характеризует себя как более эффективный материал для НКР. Впервые в клинической практике дана оценка эффективности применения этого резорбируемого барьера при восстановлении кости.
Впервые применен разработанный оригинальный метод направленной костяной регенерации.
Впервые теоретически обоснованы, экспериментально и клинически разработаны практические рекомендации по использованию «bioPlate Barier» для управляемой регенерации в стоматологической практике, что позволяет снизить инвазивность и повысить эффективность аугументации остеогенной ткани.
Теоретическая и практическая значимость работы. Получены новые данные о тканевых ответах на имплантацию костнозамещающих материалов в эксперименте. Для клинической практики разработаны рекомендации по применению резорбируемого барьера «bioPlate Barier» для НКР. Описан и рекомендован к широкому применению новый метод направленной регенерации костной ткани, позволяющий снизить травматичность и повысить эффективность ранее описанных приемов лечения атрофии десны. Расширены показания к применению дентальных имплантатов у пожилых людей.
Методология и методы исследования. Исследование выполнялось в соответствии с планом, который определял структуру, последовательность в реализации задач и объем работы. На первом, экспериментальном этапе работы, были исследованы безопасность и эффективность в условиях in-vivo. Кроме того, в экспериментальной части работы проводился сравнительный анализ биосовместимости и эффективности разработанного продукта с известными аналогами. Использованные экспериментальные модели отвечали всем необходимым этическим требованиям. Работа выполнялась в соответствии с принципами доказательной медицины.
В клинической части работы исследовалась эффективность новой барьерной мембраны и разработанного автором метода НКР.
Использованы лабораторные, морфологические, клинические, рентгенологические и статистические технологии исследования.
Завершающим этапом работы было проведение анализа полученных результатов, их статистическая обработка, оформление выводов и практических рекомендаций.
Основной целью экспериментального раздела испытаний являлось изучение реакции тканевого ответа на различные виды коллагеновых барьерных мембран.
Контролем в эксперименте послужила коллагеновая мембрана «BioGide», так как свойства этого материала хорошо изучены и подробно описаны в литературе (Buser D., 2009).
В качестве материалов для исследования использовали следующие образцы: «Опыт 1.1.» - барьерная мембрана «bioPlate Barier», разработанная для управляемой регенерации, представляющая собой двухслойную коллагеновую пластину 25 × 25 × 0,02мм на основе ксеноперикарда, обработанная при сверкритической температуре.
Объект «Опыт 1.2.» - коллагеновая «bioPlate Matrix», представляет собой однослойную пластину 25 × 25 × 0,01 мм на основе внеклеточного коллагенового матрикса.
При сравнении эффективности коллагеновых барьерных мембран различных производителей выявлено следующее: все три продукта способствуют ускорению процессов остеогенеза и могут быть использованы в практической работе. Коллагеновые барьеры российского производителя компании «Кардиоплант» не уступают по эффективности аналогам от ведущих мировых производителей.
Целью клинического раздела исследования явилось изучение возможности применения барьерной мембраны “bioPlate Barier” для НКР при атрофии альвеолярной кости.
Критериями включения пациентов в данное мероприятие служили: возраст от 20 до 64 лет, диагноз: концевые включенные и неограниченные дефекты зубодесневого отростка челюсти с атрофией I-IV степени; письменное согласие человека на участие в исследовании; отсутствие воспалительного процесса в области оперативного вмешательства; удовлетворительное гигиеническое состояние полости рта. Пациентов информировали о возможных способах хирургических вмешательств, возможных осложнениях и о характере послеоперационного периода. При наличии письменного согласия на проведение оперативного вмешательства больного включали в эксперимент.
В основу настоящей работы положены результаты обследования и лечения клиентов с частичной потерей зубов, обратившихся с целью восстановления зубных рядов в стоматологическую клинику «Садко» города Пятигорска. В клиническую часть исследования включено 119 женщин и 97 мужчин с диагнозом «частичная потеря зубов».
Всем обратившимся лечение было проведено в период с 2014 по 2018 гг. В зависимости от имеющейся патологии все больные были распределены на 4 группы. Критериями рандомизации являлись: пациенты с дефектами зубных рядов различной протяженности без дефицита тканей альвеолярного отростка, больные с дефектами зубных рядов с сопутствующей атрофией гребня II, III и IV степени. Пациентам из первой группы проводилась интеграция имплантатов без операции по направленной регенерации. Во второй сегмент вошли люди, которым осуществлялась одномоментная имплантация с костной аугментацией по методу, описанному D.Buser. В третью группу вошли клиенты, которым осуществлялась одномоментная установка имплантатов с костяной аугментацией по алгоритму, описанному автором. К четвертому сегменту были отнесены пациенты, у которых пластика гребня по методу, описанному автором, и установка дентальных имплантов проводилась в два этапа. Участники первой группы – 49 больных, составили контрольную группу исследования. Пациенты второго - 53 человека, третьего - 69 больных и четвертого сегментов - 45 больных, составили первую, вторую и третью опытные группы.
Всем обследуемым был проведен клинический и рентгенологический анализ состояния челюстных костей перед операцией. Мы не определили разницы в степени атрофии челюстей по гендерному типу. Всем пациентам после успешного приживления имплантатов проводилось зубное протезирование. Для выполнения поставленных задач проводили клиническое и лабораторное обследование участников. В анамнезе изучали жалобы больных, причины обращения за таким видом стоматологической помощи, как дентальная имплантация, причины и сроки удаления зубов, анализировали характер проводимого после этого ортопедического лечения.
Методы оперативных вмешательств. Интеграция имплантов при атрофии альвеолярного отростка 1 степени, когда толщина вестибулярной костной стенки после установки составляет более 1 мм, проводилась без управляемой регенерации. В данной ситуации внедрение дентальных имплантатов проводится по стандартному протоколу, при этом, если показатели торка (вращающегося момента) при установке были более чем 30 Н/см, формирователь десны устанавливался сразу.
При установке имплантатов в условиях атрофии гребня II степени, когда толщина вестибулярной стенки после операции составляет менее 1 мм, проводили восстановление кости с применением партикулированного графта и с использованием резорбируемой барьерной мембраны. Принцип данной методики описанной Buser D., но в нашей практике для НКР мы применяли материалы отечественного производства. Установку дентальных имплантов проводили по стандартному двухэтапному протоколу.
При имплантации в условиях атрофии III степени, когда в процессе установки обнажается поверхность имплантата, нами предложен способ направленной регенерации с использованием барьерной мембраны, основанный на принципе фиксации графта с помощью надкостничного лоскута. В процессе реализации данного способа достигается снижение инвазивности аугментации в сравнении с такими методами, как расщепление зубодесневого гребня, за счет снижения болезненности и продолжительности хирургического вмешательства. Установка дентальных имплантов проводили одномоментно с аугментацией костяного гребня по стандартному двухэтапному протоколу (рис.1-8).
Имплантацию в условиях атрофии десны IV степени проводили через 4 месяца после управляемой регенерации. При этом аугментацию выполняли по предложенной нами методике, установку дентальных имплантатов по стандартному протоколу.
Оценка результатов клинических исследований. Всем пациентам проводилась конусно-лучевая компьютерная томография, во время которой определялись такие рентгенологические показатели, как высота и ширина альвеолярного отростка, оптическая плотность костной ткани по Хаунсфилду.
По данным конусно-лучевой компьютерной томографии высота альвеолярной части нижней челюсти колебалась от 8.0 до 17.0 мм при ширине от 6.0 до 10.0 мм, оптическая плотность кости по Хаунсфилду была в пределах от 800 до 900. Данная плотность эквивалентна клиническому типу кости D2. При обследовании верхней челюсти выявлено, что высота гребня составила от 8.0 до 17.0 мм, ширина от 6.0 до 12.0 мм. Оптическая плотность костной ткани по шкале Хаунсфилда соответствовала 550-800 единиц, что эквивалентно типу D3.
Объем костяной ткани гребня у пациентов 1 исследуемой группы (53 человека) был оптимальным для установки дентальных имплантатов с проведением регенерации по D. Buser. По данным КЛКТ высота альвеолярной части нижней челюсти колебалась от 7.0 до 16.0 мм, ширина от 4.0 до 6.0 мм, оптическая плотность кости от 800 до 1100 единиц по шкале Хаунсфилда, что соответствует типу D2. Полезная высота зубодесневого отростка верхней челюсти составила от 8.0 до 16.0 мм, ширина от 4.0 до 6.0 мм, плотность костной ткани по шкале Хаунсфилда 450-750 единиц, что соответствует в основном типу кости D3.
Объем альвеолярного гребня у пациентов 2 исследуемого сегмента (69 человек) требовал с установкой дентальных имплантов проведения НКР. У этих пациентов увеличение объема костной ткани проводили по алгоритму, описанному нами.
По данным конусно-лучевой компьютерной томографии высота альвеолярного отростка нижней челюсти определялась от 8.0 до 12.0 мм, при ширине от 3.0 до 4.0 мм. Оптическая плотность по шкале Хаунсфилда составляла от 900 до 1200 единиц, что соответствует клиническому типу D2. При исследовании верхней челюсти высота гребня составила от 8.0 до 14.0 мм, при ширине от 3.0 до 4.0 мм. Оптическая плотность костной ткани по шкале Хаунсфилда составляла 300-600 единиц, что соответствует клиническому типу кости D3.
Объем зубодесневого гребня у пациентов 3 исследуемой группы (45 человек) не был оптимальным для выполнения дентальной имплантации, поэтому имплантаты ставились вторым этапом, спустя 4-5 месяцев после проведения НКР по нашему методу. При исследовании нижней челюсти с помощью конусно-лучевой компьютерной томографии, высота альвеолярной части колебалась от 7.0 до 12.0 мм, ширина от 1.0 до 3.0 мм. Оптическая плотность костяной ткани по шкале Хаунсфилда соответствовала от 1000 до 1300 единиц. Данная плотность эквивалентна клиническому типу кости D1. Высота альвеолярного гребня верхней челюсти составила от 6.0 до 13.0 мм, ширина от 1.0 до 3.0 мм. Оптическая плотность кости по шкале Хаунсфилда определялась в промежутке 200-400 единиц, что соответствует типу кости D4.
При анализе частоты той или иной степени атрофии при включенных и концевых дефектах зубных рядов установлено, что лишь 23% обратившихся за имплантологической помощью не нуждаются в костной регенерации. А порядка 21% обращаются с выраженной степенью атрофии, что требует проведение такого дополнительного этапа, как остеопластика.
Пациентам, согласно операционного протокола, устанавливали имплантаты и проводили направленную костную реконструкцию в соответствии со степенью атрофии.
В послеоперационном периоде выполняли тщательную щадящую гигиену полости рта; антисептические ротовые ванночки; по показаниям – антибактериальную терапию.
Осмотр пациентов проводили на следующие сутки после вмешательства, на третьи сутки, через 7 и 10 дней. Швы снимали на 10-14 сутки.
По данным опроса больных в раннем послеоперационном периоде у участников 1группы болевой синдром практически отсутствовал, в большинстве случаев анальгетики не принимали, как правило, боль прекращалась на третьи сутки после операции. У пациентов II сегмента болевой синдром был слабовыраженным, примерно в половине случаев анальгетики принимали в первые три дня после операции, болевой синдром прекращался к четвертым-пятым суткам после операции. У участников III группы чаще наблюдалась умеренно выраженная боль, у четырех человек наблюдался выраженный болевой синдром, у двух – крайне выраженный. У пациентов IV сегмента, как и в III, чаще наблюдалась умеренно выраженная боль, у 8 больных наблюдался выраженный болевой синдром, у двух – крайне выраженный. При сравнении субъективных жалоб в группах с применением bioPlate Barrier и Bio Gide выявлено следующее: нарушения чувствительности кожи нижней части лица пациенты не отмечали.
Сравнение клинических признаков в послеоперационном периоде показало, что отек был незначительным в I контрольной и II группах. Среднее значение показателя клинического ответа на вмешательство в этих сегментах составило 0.5 ± 0.6 и 0.7 ± 0.6 балла соответственно. Чаще более выраженные проявления отека встречались в III, там где установка имплантатов сопровождалась направленной остеопластикой в условиях атрофии альвеолярного гребня III степени. Среднее значение показателя в этой группе достигло 1.6 ± 0.8 балла. В четвертой группе, там где на первом этапе проводилась только операция по костной регенерации, ответ на вмешательство со стороны тканей полости рта был более выраженным по сравнению с остальными сегментами, среднее значение показателя составило 1.9 ± 0.7 балла.
Согласно T-критерию Манна-Уитни для больших выборок с поправкой Йейтса при сравнении тканевого ответа на bioPlate (Россия) и bioGide (Швейцария) разница была статистически недостоверна во второй и четвертой группах, тогда, как в третьей показатель тканевого ответа на барьерную мембрану российского производства статистически достоверно ниже.
В целом, анализ результатов клинической оценки свидетельствует, что предложенный нами метод НКР сопоставим по ответу на операционную травму со способом управляемой костной регенерации по D. Buser, хотя и проводится в условиях более выраженной атрофии гребня. При сравнении тканевого ответа на bioPlate (Россия) и bioGide (Швейцария) разница практически не определяется, хотя показатель тканевого ответа на барьер российского производства несколько ниже.
Рентгенологический контроль проводили через 3 и 6 месяцев после операции. Целью рентгенологического контроля являлся мониторинг состояния перимплататной костяной ткани и мониторинг созревания аугментата. Для статистической оценки эффективности использования барьерных мембран применялся непараметрический критерий Фридмана. Сравнивались данные конусно-лучевой компьютерной томографии, полученные до и через 6 месяцев после лечения. Сравнение проводилось по трем признакам: высоте, ширине и оптической плотности костной ткани зубодесневого отростка в зоне реконструкции. По всем трем признакам наблюдаемые значения критерия Фридмана многократно превзошли критические значения, значит различия до и после лечения статистически значимы.
В целом, результаты экспериментальных и клинических исследований показали, что барьерная мембрана российского производителя bioPlate Barier представляется наиболее эффективным материалом для направленной регенерации кости и может быть рассмотрена в качестве адекватной альтернативы аналогичным материалам импортного производства. Кроме того, не выявлено статистически значимых различий между используемыми типами имплантатов различных производителей.
Анализ полученных данных по методу направленной остеопластики позволяет заключить, что алгоритм восстановления альвеолярного гребня, описанный и предложенный нами, позволяет снизить количество нежелательных проявлений в послеоперационном периоде у пациентов с патологией, требующей хирургического вмешательства по восстановлению дефектов гребня в амбулаторной стоматологической практике.
Выводы:
1. Исследуемая барьерная мембрана полностью биосовместима и безопасна. Не уступает по своим свойствам зарубежным аналогам.
2. Результаты экспериментально-морфологического исследования показали, что применение «bioPlate Barier» эффективно для устранения костяных дефектов. Продукт не вызывает воспалительной реакции со стороны окружающих тканей. Морфологическое изучение блоков, взятых из зоны аугментации у лабораторных животных показало, что материал проявляет выраженные остеокондуктивные и остеоиндуктивные свойства.
3. Применение отечественной резорбируемой «bioPlate Barier» делает методы управляемой регенерации более доступными для пациентов, а результаты операции дентальной имплантации более эффективными и предсказуемыми в сравнении с аналогичными методиками. Разработанный оригинальный способ НКР обладает низкой степенью инвазивности по сравнению с такими приемами, как увеличение объема кости с помощью костных блоков и практикой расщепления зубодесневого гребня.
4. По данным рентегенологических и клинических исследований доказано, что барьерная мембрана «bioPlate Barier» при новом методе направленной костяной регенерации надежно фиксирует костнозамещающий материал в ране, осуществляет барьерную функцию и способствует полноценному остеогенезу. Применение резорбируемого барьера нового поколения «bioPlate Barier» становится критерием выбора при лечении обратившихся с дефицитом костной ткани челюстно-лицевой области способом направленной регенерации.
Практические рекомендации:
1. Для устранения дефектов десны при атрофии II степени рекомендован метод НКР с применением костнозамещающих материалов и барьерной мембраны «bioPlate Barier».
2. Для устранения дефектов альвеолярного гребня при атрофии III степени рекомендован разработанный и предложенный нами алгоритм остеопластики, основанный на расщеплении слизистонадкостничного лоскута с применением костнозамещающих материалов и резорбируемого барьера «bioPlate Barier». Данная технология при атрофии III степени предполагает одномоментную установку имплантов.
3. Для устранения дефектов при атрофии IV степени рекомендован разработанный и предложенный нами принцип управляемой костяной регенерации, основанный на расщеплении слизистонадкостничного лоскута с применением костнозамещающих материалов и барьерной мембраны «bioPlate Barier». Данный подход при атрофии IV степени предполагает внедрение имплантатов по отсроченному протоколу.
Автореферат диссертации на соискание ученой степени кандидата медицинских наук Бойко Е.М
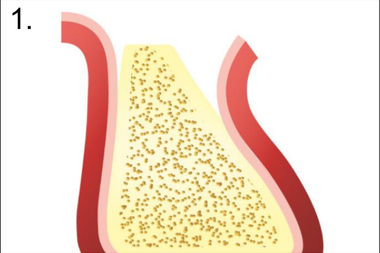
1. Отслаивание слизисто-надкостничного лоскута
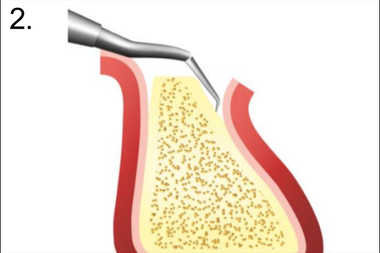
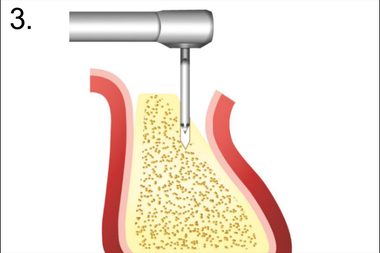
3. Декортикация бором
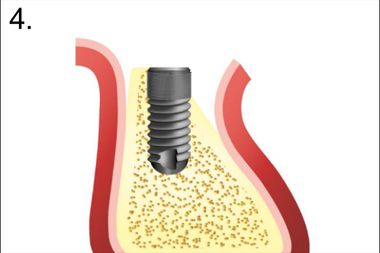
4. Установка имплантата
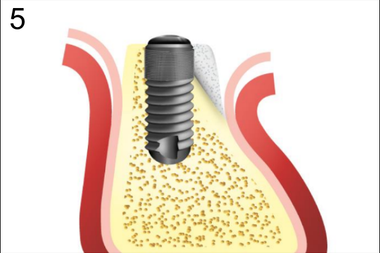
5. Закладка графта
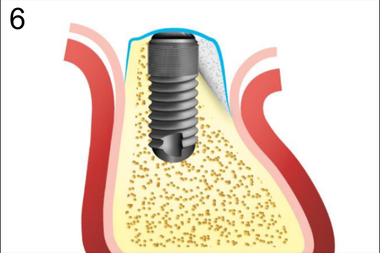
6. Укладка резорбируемого барьера
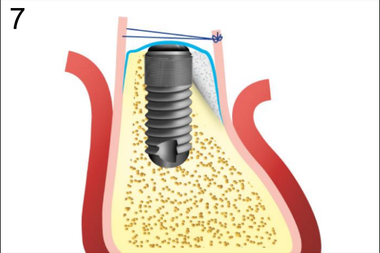
7. Ушивание краев надкостницы
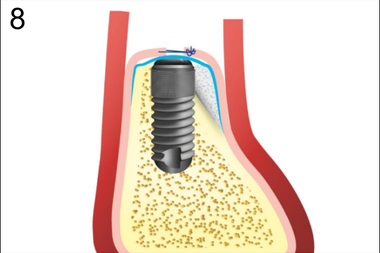
8. Фиксация надкостницы

