На некоторые товары неверно отображаются цены.
Уточняйте цены у менеджера.
Соединительнотканный трансплантат для регенерации мягких тканей - полноценная замена аутогенным трансплантатам.
-
Увеличение объема мягких тканей
-
Вестибулопластика
-
Пародонтальная хирургия
Резюме
Цель. Оценка эффективности применения 3D-матрикса FibroMATRIX для мягкотканных реконструкций ротовой полости при хирургическом лечении атрофии десны I класса по Миллеру.
Материалы и методы. Проведено обследование и лечение 25 пациентов. Всем обследуемым проведено хирургическое нивелирование рецессий с применением двухслойных методик устранения с использованием «3D коллагенового матрикса FibroMATRIX» для восстановления десневой структуры. Результат оценивали через 7,14 суток, 1 и 3 месяца. Статистическую обработку исследований проводили в программе GraphPadPrism v.6.0, с использованием t-критерия. Различия считались достоверными при р < 0,05.
Результаты. Оценка закрытия десневых пороков и показала ее значимое (р < 0,05) увеличение, соответствующее 73% эффективности после проведения лечения в обоих группах пациентов, достоверных различий в обоих группах выявлено не было. Лучшие клинические показатели были достигнуты при устранении повреждений во фронтальном отделе верхней челюсти и соответствовали 100% эффективности.
Выводы. Применение 3D коллагенового матрикса FibroMATRIX для регенерации мягких тканей полости рта является эффективным методом лечения десневых изъянов I класса по Миллеру
На сегодняшний день в современной стоматологической практике актуальной проблемой является атрофия десны. Она характеризуется как невоспалительное апикальное смещение десневого края от его физиологического положения с обнажением поверхности корня. По данным некоторых авторов, интенсивность и распространенность опущения десны прямо пропорциональна возрасту и достигает 99,7% у взрослого населения.
В мире существуют несколько классификаций десневых дефектов, предложенных различными авторами. Наибольшее распространение получила классификация Миллера (1985), в которой рецессия десны делится на 4 класса в зависимости от положения апикального края свободной десны относительно мукогингивальной границы и сохранения альвеолярных межзубных костных перегородок. В настоящее время успех, характеризующийся полным устранением десневого смещения, прогнозируем и возможен на ранних стадиях заболевания, а именно при пороках I-II класса по Миллеру, в отношении III и IV классов лечение является малоперспективным.
Существуют различные методы устранения этой проблемы, включающие консервативное и хирургическое лечение. Наиболее прогнозируемым видом является хирургическое, так как оно позволяет получить стойкое увеличение объёма десны. Хирургическое лечение является этиопатогенетическим, так как устраняется не только эстетический недостаток и гиперчувствительность, но и часть этиологических факторов, существенно уменьшая риск развития кариеса корня и потери зуба.
Для увеличения зоны кератинизированной прикрепленной десны «золотым стандартом» признано использование свободного соединительнотканного трансплантата (ССТ). Тем не менее многие пациенты не дают согласия на дополнительные хирургические вмешательства, связанные с манипуляциями на их собственных тканях. Данные методики имеют ряд недостатков: наличие дополнительного операционного поля, риск возникновения осложнений, связанных с забором аутотрансплантата, кровотечения, болевой синдром, обусловленный взятием собственной аутоткани пациента, так и ее ограниченный объем. Поэтому на сегодняшнее время крайне актуальным является поиск видов хирургического лечения с использованием альтернативных методов использования аутогенных трансплантатов.
Альтернативой использования аутотрансплантатов является применение ксеногенных коллагеновых матриц. На мировом рынке представлено множество трансплантационных материалов для замещения мягкотканых дефектов в пародонте. Подобные материалы обладают рядом преимуществ, так как доступны в неограниченном количестве, хорошо интегрируются в мягкие ткани и снижают риск возникновения осложнений, связанных с наличием дополнительного операционного поля при заборе аутотрансплантатов.
Сравнительно недавно в Российской Федерации разработан и зарегистрирован новый материал – «3D матрикс коллагеновый FibroMATRIX» (Рег.уд. РЗН№2019/8367 от 20.05.2019г.). FibroMATRIX представляет собой ксеногенный 3D-матрикс для регенерации мягкого покрова полости рта. Данный фиброматрикс изготавливается по уникальной, запатентованной технологии (Патент РФ №2683328), которая позволяет получить тщательно очищенное от иммунных агентов изделие необходимой толщины. В ходе проведения доклинических лабораторных исследований данный материал показал свою эффективность и цитотоксичность в отношении пролиферации культур клеток in vitro. Эксперименты на животных доказали биосовместимость и безопасность.
Поэтому актуальным является применение «3D коллагенового матрикса FibroMATRIX» для воссоздания слизистой оболочки полости рта в клинической стоматологической практике при ликвидации десневых смещений.
Цель исследования: Оценка эффективности применения FibroMATRIX для регенерации мягких тканей ротовой полости при хирургическом лечении рецессии десны I класса по Миллеру (МКБ -10 К 06.0).
Материалы и методы: Для реализации цели исследования было проведено обследование и лечение клиентов, обратившихся на кафедру терапевтической стоматологии с курсом ИДПО БГМУ г. Уфа и в стоматологическую клинику Дентал-Студия ООО «Дина Медсервис» г. Уфа в период с 2019-2020 гг.
Объектом исследования явились 25 человек (73,4 % женщин и 26,6% мужчин) в возрасте от 20-45 лет, с диагнозом атрофия десны (МКБ -10 К 06.0) I класса по Миллеру. В исследование были включены только пациенты, считающие себя соматически здоровыми, с отсутствием аллергического анамнеза, письменно давшие информированное согласие о ходе и методах проводимого исследования.
Комплексное стоматологическое обследование клиентов проводили по общепринятой стандартной методике, включающей: опрос, внешний осмотр, осмотр полости рта. Оценку гигиенического и пародонтологического статуса пациентов определяли с использованием индексов: КПУ, упрощенный гигиенический индекс OHI-S (J.C.Green, J.R.Vermillion, 1964), индекс кровоточивости межзубных сосочков (PBI – papilla bleeding index; Saxer, Mühlemann, 1975). Класс рецессии определяли с использованием классификации Миллера (P.D. Miller, 1985). Хирургические вмешательства проводили при OHI-S < 1,7 и PBI < 5%, которые указывали на отсутствие клинически значимого воспаления пародонта и, как следствие, высокое содержание коллагена в собственных мягких тканях полости рта.
При клиническом обследовании включали данные о высоте и ширине, распространенности десневого порока, ширине зоны кератинизированной прикрепленной десны в области смещения, наличию слизистых тяжей, аномалий уздечек губ и т.д. Для оценки метрических параметров использовали градуированный пародонтологический зонд (HLW, Германия).
Проведена оценка толщины десны и ее биотипа. Биотип определяли с помощью рентгенографического исследования методом конусно-лучевой компьютерной томографии, с использованием специально разработанной нами техники проведения данного метода для визуализации толщины прикрепленной кератинизированной десны. При регистрации толщины десны менее 1,0 мм биотип считали тонким, при 1 мм и более биотип считали толстым.
Для оценки состояния челюстных костей применяли рентгенографическое исследование методом конусно-лучевой компьютерной томографии (Vatech, Ю. Корея). Оценивали наличие деструкций костных структур, наличие или отсутствие потери высоты костяных межзубных перегородок, целостность кортикальной вестибулярной пластинки в области десневых изъянов.
Перед проведением хирургических манипуляций, не менее чем за 48 часов до оперативного вмешательства, всем пациентам была проведена комплексная профессиональная гигиена полости рта (Scaling& Root Planing).
Всем клиентам (100%) проведено хирургическое лечение с применением двухслойных методик устранения множественных и одиночных рецессий с использованием «3D коллагенового матрикса FibroMATRIX» (Кардиоплант, Россия) для восстановления слизистых покровов полости рта.
В зависимости от показаний, пациенты были поделены на 2 группы.
При наличии абразивных/кариозных пришеечных дефектов зубов и высоте рецессии более 3мм и наличии зоны прикрепленной кератинизированной десны апикальнее повреждения менее 3 мм, пациентам проведено хирургическое лечение с использованием метода коронального смещенного лоскута (Дж.Зуккели, 2000).
При наличии десневого смещения не более 3мм, ширине зоны прикрепленной кератинизированной десны >3 мм апикальнее дефекта, при одиночных рецессиях – пациентам было проведено хирургическое лечение с помощью модифицированной тоннельной методики (О.Цур, М. Хюрцеллер, 2012).
В первую группу включены 12 человек (8 женщин и 4 мужчины) с диагнозом «МКБ -10 К 06.0 Рецессия десны» I класса по Миллеру. Всем пациентам были даны послеоперационные рекомендации по стандартному протоколу. Снятие швов проводили на 14й день. Послеоперационный осмотр проводили на 7,14 сутки, через 1 месяц после операции. Эффект манипулятивных действий оценивали через 1 месяц.
Второй группе, в которую вошли 13 человек (10 женщин и 3 мужчины) с диагнозом «МКБ -10 К 06.0», была проведена модифицированная тоннельная техника. Всем пациентам были даны послеоперационные рекомендации по стандартному протоколу. Послеоперационный осмотр проводили через 1 и 2 недели. Снятие швов проводили на 14 сутки. Результат оценивали через 1 и 3 месяца. Наблюдение за больными продолжали вплоть до 3 месяцев после вмешательства.
Все хирургические манипуляции проводили под визуальным контролем, в ходе каждой операции был произведен фотопротокол в режиме макросъёмки: фотоаппарат Сanon 550D (Canon, Япония), Canon EF-S 60mm f/2.8 Macro USM, кольцевая вспышка Canon Macro Ring Lite MR-14 EX.
Критерии эффективности проведенного операционного вмешательства включали в себя следующие: % увеличения зоны прикрепленной кератинизированной десны, отсутствие цветовых и фактурных различий, % устранения десневой рецессии (100% соответствовало восстановлению свободного десневого края до цементно- эмалевой границы зуба ), отсутствие карманов при зондировании, устранение повышенной чувствительности, удовлетворенность пациента эстетическим результатом.
При осмотрах оценивали:
1. Наличие отека мягких тканей полости рта по трехбалльный системе (0 – отсутствие отека; 1 – легкий отек; 2 – сильный отек).
2. Наличие фибринового налета и состоятельность швов по трёхбалльной системе (0– отсутствие фибрина по линии разреза, швы состоятельны; 1– легкий фибринозный налет по линии разреза, швы состоятельны; 2– фибрин покрывает линию разреза, швы не состоятельны).
3. Болевой синдром по 4х бальной шкале (0- болевой синдром после вмешательства отсутствовал, приема анальгетиков не потребовалось; 1- небольшие болевые ощущения, прием анальгетика – суммарная доза до 300 мг; 2- умеренная боль, прием анальгетика – суммарная доза до 1000 мг; 3- выраженная боль, прием анальгетика – суммарная доза более 1000мг).
Статистическую обработку исследований проводили в программе GraphPadPrism v.6.0 for Windows системы Microsoft Office, с использованием t-критерия, Манна – Уитни. Различия считались достоверными при р < 0,05.
Клинический пример: Пациентка А., 30лет. Диагноз: К 06.01 Рецессия десны, I класс по Миллеру.
Локальная атрофия в области 14 зуба 2мм (фото 1, 2). Ширина кератинизированной десны апикальнее дефекта более 3мм. Биотип десны толстый, десневые сосочки в норме. Планируется ортодонтическое лечение. Предоперационную обработку полости рта проводили 0,12% раствором хлоргексидина в течении 1 минуты. Под инфильтрационной анестезией Sol. Ultracaini D-S 1,7мл провели внутрибороздковый разрез с использованием микрохирургического скальпеля (MANI, Япония). Обнаженные поверхности корней зубов тщательно обрабатывали на высоту потери клинического прикрепления в 4 этапа:
1. ультразвуковая обработка;
2. инструментальная механическая обработка с использованием кюрет Грейси Mini-Five;
3. полировка и сглаживание поверхности корней зубов с использованием пародонтологических боров РА;
4. медикаментозная обработка аппликацией линкомицина гидрохлорида 30 мг/мл в течении 2 минут.
Тоннельным распатором произвели отслаивание слизистого расщепленного лоскута и подготовку тоннельного ложа. Коллагеновый 3D матрикс FibroMATRIX (Кардиоплант, Россия) регидратировали в 0,9% NaCl, адаптировали по размерам (фото. 3) и ввели в тоннельное ложе с помощью направляющих, позиционирующих швов Prolene 5.0. Слизистая фиксирована коронально, полностью покрывая повреждение до цементно эмалевой границы. Ушивание раны проведено с помощью двойных обвивных швов Prolene 5.0 (фото 4). Послеоперационную медикаментозную обработку проводили 0,12% раствором хлоргексидина. Снятие швов через 14 дней. Наблюдается полное устранение десневой рецессии в области 14 зуба (фото 5).
Результаты исследования: По итогам опроса и сбора анамнеза было определено, что 17,2% пациентов курили, у 1 пациента (4%) имелось наличие пирсинга нижней губы, ортодонтическое лечение в анамнезе соответствовало 25,8% пациентам.
Основные жалобы пациентов при обращении являлось наличие повышенной чувствительности зубов, эстетическая неудовлетворенность, в 15% случаев пациенты отмечали кровоточивость при чистке зубов.
При индексной оценке гигиенического и пародонтологического состояния полости рта, были получены следующие результаты (Таблица 1).
| КПУ | OHI-S | PBI |
| 16,0 ± 0,67 | 1,78 ± 0,12 | 1,32 ± 0,14 |
Суперконтакты при центральной окклюзии наблюдались у 31% пациентов, наличие абразии, клиновидных дефектов и реставраций в пришеечной зоне зуба отмечены у 33,4% пациентов.
При комплексном обследовании выявлено 67 зубов с рецессиями десны I класса по Миллеру. Генерализованная форма смещения (более 3 зубов) отмечена у 73,4% пациентов, локализованная форма у 26,6% пациентов. Хронический генерализованный пародонтит легкой и средней степени тяжести наблюдался у 26,7% пациентов. Тонкий биотип десны соответствовал 60% случаев, толстый биотип - 40% случаев. Толщина десны при тонком биотипе составляла 0,8± 0,94мм, при толстом биотипе 1,2±0,87мм. Наличие десневых дефектов I класса по Миллеру в области слизистых тяжей и уздечек губ соответствовало 26,6% случаев.
В период с 2019-2020 год было пролечено 9 зон атрофированной десны I класса по Миллеру на фоне тонкого биотипа, 4 пациента на фоне воспалительных заболеваний пародонта. Общее количество зубов с десневым смещением 1 класса по Миллеру составило 49 зубов. Глубина повреждений до лечения в среднем составляла 2,95 ± 1,14 мм, ширина пороков до лечения 4,02± 0,19мм.
Анализ результатов статистики при ликвидации рецессии десны I класса по Миллеру двумя разными хирургическими методами показал, что в каждой группе конечные итоги оказались сопоставимы.
Оценка закрытия смещения десны и ширины прикрепленной кератинизированной десны показала ее значимое (р < 0,05) увеличение после проведения лечения в обоих группах пациентов, при этом достоверных различий в обоих группах выявлено не было.
Анализ данных по устранению десневых изъянов I класса по Миллеру у пациентов в 100% случаях показал среднее значение эффективности, которое составило 73 % (Таблица 2).
| Челюсть | Количество зубов | Размер рецессии | Время наблюдения | % закрытия |
| Верхняя чел. | 34 | 1-3 месяца | ||
| Фронтальный отд. | 28 | 4 ± 1,2 мм | 99 | |
| Боковой отдел | 6 | 3 ± 0,8 мм | 100 | |
| Нижняя чел. | 15 | 1-3 месяца | ||
| Фронтальный отд. | 12 | 2,8 ± 0,3 мм | 58 | |
| Боковой отдел | 3 | 2,6 ± 0,4мм | 34 |
Обсуждение: Лучшие клинические результаты были достигнуты при устранении повреждений во фронтальном отделе верхней челюсти, причем и при тонком и при толстом биотипе и соответствовал 100% эффективности закрытия порока.
У 3 пациентов был отмечен неудовлетворительный результат, что соответствовало 34% устранения дефектов на нижней челюсти в боковом отделе. В случаях проведения оперативного лечения десневой рецессии I класса по Миллеру у пациентов во фронтальном отделе нижней челюсти результат соответствовал 58% эффективности закрытия дефекта.
В послеоперационном периоде самые высокие показатели болевой чувствительности отмечались на 1 сутки и соответствовали значению 1,2 ± 0,86 балла, что достоверно выше (р < 0,05) значений показателей на 1(0 баллов), 2 недели (0 баллов) (рис. 6). Отек мягких тканей в зоне проводимого оперативного вмешательства составлял 1,67± 0,48 балла на 1 день и 1,53± 0,63 балла на 3 день, снижая свои показатели к концу первой недели до полного отсутствия (0 баллов).
Состоятельность швов соответствовала в среднем низким показателям, максимальное значение наблюдалось на 7 сутки (0,4 балла), что не имеет статистически значимой разницы (р>0,05), по сравнению с результатами на 1(0 баллов), 3(0,34 балла),14 день (0,067 баллов).
Таким образом выраженность болевой чувствительности и фибринозного налета была незначительной в послеоперационном периоде. Послеоперационный отек слизистой был выраженным на 1 сутки, значительно снижая свои показатели уже на 3-7 день.
Выводы:
1. Применение 3D коллагенового матрикса FibroMATRIX для регенерации мягких тканей полости рта является эффективным методом лечения десневой рецессии I класса по Миллеру.
2. Для достижения стабильных отдаленных результатов необходимо использовать хирургические двухслойные техники по показаниям.
3. В послеоперационном периоде при использовании 3D-матрикса FibroMATRIX для реконструкции мягких тканей полости рта при лечении повреждений наблюдается болевая чувствительность и выраженный отек мягкого покрова в день операции, снижая свою интенсивность уже к 3 суткам.
4. Использование FibroMATRIX для реконструкции десневых дефектов рта является хорошей альтернативой использования аутогенных соединительнотканных трансплантатов.
Фархшатова Р.Р., Герасимова Л.П., Кабирова М.Ф. Федеральное государственное бюджетное образовательное учреждение высшего образования «Башкирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Уфа, Россия

Рецессия десны I класса по Миллеру в области 14 зуба

Измерение высоты с помощью пародонтологического зонда

Адаптация по размерам 3D коллагенового матрикса FibroMatrix на область сформированного «тоннеля»

Вид операционной раны после ушивания Supramid 5.0

Вид операционной раны на 14 сутки после снятия швов. Полное восстановление объема

Оценка показателей болевой чувствительности, отека и состоятельности швов в послеоперационном периоде у пациентов

1. Множественная атрофия в области 14-11 зубов. Десневые сосочки в норме. Предоперационно обрабатываем полость рта 0,12% раствором хлоргексидина в течение 1 минуты для максимального уничтожения резидентной и транзиторной микрофлоры.

2. Под инфильтрационной анестезией выполняем скальпелем №15С подпередний и парамаргинальный косые разрезы в коронковой части лоскута для формирования хирургических сосочков.

3. Формируем фестончатый сосочковый разрез и отделяем послойно-слизистый лоскут острым методом с помощью скальпеля и тупым методом, используя распатор.

4. Обработка обнаженных поверхностей зубов в 4 этапа, включая деэпиталицацию, полировку и выравнивание поверхности корней пародонтологическими борами.

5. Регидратация фиброматрикса в аутогенной богатой тромбоцитами плазме в течении 2 минут.

6. Коллагеновый матрикс помещен в сформированый слизистый «конверт»

7. Коллагеновый ксенотрансплантат зафиксирован узловыми швами

8. Закрываем FibroMatrix слизистым лоскутом, максимально смещая его до закрытия 3d-матрикса, фиксируем узловыми швами. Вид сразу после операции.

9. Швы сняты через 14 дней. Результат через 1месяц после операции.

1. Множественные рецессии в области 22-25 зубов от 1 до 3мм. Биотип десны толстый, десневые сосочки в норме. Планируется ортодонтическое лечение.

2. Туннельным распатором отслаиваем слизистые ткани, подготавливаем туннельное ложе.

3. Адаптированный в соответствии с размерами дефекта и регидрированный в аутоплазме, фиброматрикс помещается в тоннель и фиксируется узловыми швами.

4. Слизистая оболочка фиксируется коронально, полностью закрывая повреждения до границы эмали. Закрытие раны выполняли двойными швами.

5. Вид через 14 дней перед снятием швов. Полное восстановление десны.

6. Контрольный осмотр через 3 месяца. Мягкие ткани стабильны.
Цель работы: сравнительный анализ сочетанного применения препаратов активированной аутоплазмы, гиалуроновой кислоты и ксеногенного 3D-матрикса in vitro.
Материал и методы. Для эксперимента использовались фибробласты из легких эмбриона человека. Оценивалась пролиферативная активность фибробластов в присутствии активированной плазмы, гиалуроната и 3D-матрикса Fibromatrix для регенерации мягких тканей полости рта. Оценку цитотоксичности и пролиферативной активности проводили через 1, 3 и 7 суток посредством колориметрического МТТ-теста. Результаты регистрировались с помощью микроскопического исследования и фотографирования в проходящем свете.
Результаты. Было установлено, что стабильный активный рост фибробластов наблюдался при сочетанном использовании фиброматрикса и активированной плазмы. Препарат на основе гиалуроновой кислоты способствует пролиферации фибробластов человека, однако позже активность снижается, ингибируя рост клеток к окончанию 1 недели.
Заключение. Представленные результаты демонстрируют перспективность применения комбинации тромбоцитарной аутоплазмы и коллагенового 3D-матрикса для регенерации мягких тканей полости рта в клинической практике.
На сегодняшний день проблема заболеваний пародонта является актуальной в структуре стоматологических патологий в связи с широкой распространенностью и недостаточной эффективностью проводимого лечения. Распространенность десневой рецессии достигает 99,7% у взрослого населения. Причем, с возрастом ее распространенность возрастает.
Для устранения десневой рецессии основным методом является хирургическое лечение. В настоящее время разработаны «классические» методики с использованием лоскутных техник, аутотрансплантатов и др., которые широко применяются в клинической практике. Для увеличения зоны кератинизированной прикрепленной десны «золотым стандартом» признан свободный соединительно-тканный трансплантат. Подобные вмешательства имеют ряд недостатков, связанных с неудовлетворительным эстетическим результатом и необходимостью дополнительного операционного вторжения с целью забора аутотрансплантата.
В настоящее время активно разрабатываются различные хирургические техники. Перспективной областью является применение новых биоматериалов совместно со стандартизированными хирургическими протоколами. Альтернативой использования аутотрансплантатов для восстановления утерянного объёма пародонта являются аллогенные коллагеновые матрицы, которые обладают рядом преимуществ: доступны в неограниченном количестве, хорошо интегрируются в организм и снижают риск возникновения осложнений, связанных с наличием дополнительного операционного поля при заборе аутотрансплантатов.
Ряд клинических и экспериментальных работ посвящены исследованию аутогенной тромбоцитарной плазмы как эффективного кератопластического средства при воспалительных заболеваниях пародонта.
Для влияния на процессы регенерации мягких тканей многие авторы предлагают использовать препараты на основе гиалуроновой кислоты. В некоторых исследовательских работах гиалуронан применялся для нивелирования повреждений мягких тканей, предотвращения инфицирования операционных ран в комплексном лечении заболеваний пародонта, для восстановления утраченных межзубных сосочков.
Таким образом, на современном этапе развития мукогингивальной пластической хирургии актуальным является поиск новых методов и способов хирургического закрытия десневых повреждений с использованием новейших биоматериалов и препаратов, позволяющих повысить эффективность проводимого лечения. Одним из актуальных подходов к терапии является сочетание препаратов на основе гиалуроната, тромбоцитарной аутоплазмы и аллогенного 3D-матрикса для регенерации мягких тканей полости рта.
Для выяснения перспектив использования различных методов и видов имплантируемых материалов в клинической практике важным этапом является исследование in vitro на клеточных модельных системах.
Проведен сравнительный анализ перспективы сочетанного применения препаратов на основе активной плазмы, гиалуроновой кислоты и коллагеновой 3Dматрицы in vitro.
Задачи: 1. Оценка пролиферативной активности фибробластов человека в присутствии активированной плазмы или в комбинации ее с 3D-матриксом. 2. Оценка роста и деления фибробластов в присутствии гиалуроновой кислоты или препарата на основе гиалуроновой кислоты на Фиброматриксе. 3. Сравнительная оценка пролиферации фибробластов человека при культивировании в присутствии препарата на основе гиалуроната, активированной плазмы и коллагенового 3D-матрикса.
Материал и методы
1.1. Культивирование клеток. Для эксперимента in vitro были использованы клетки фибробластоподобной линии из легких эмбриона человека (ФЛЭЧ-104, Биолот, Россия). Их культивировали в полной среде α-MEM (Gibco), содержащей 10% эмбриональной телячьей сыворотки (Biowest, Франция), 2 мМ L-глютамина и 40 ед/мл гентамицина, в условиях инкубатора при температуре 37°С, 100% влажности и содержании CO2 5%. Культуральную среду заменяли на новую каждые 3-4 дня. По достижении 70-80% конфлюэнтности - пересевали. Для этого ФЛЭЧ-104 снимали с подложки с помощью раствора трипсина ЭДТА 0,25% (ПанЭко, Россия), подсчитывали на автоматическом счетчике TC20 (BioRad, США) и рассевали плотностью 4×104 на 1 см2 объемом 25 см2 в культуральные флаконы. Для проведения дальнейших экспериментов использовали клетки 1-3-го пассажей.
1.2. Подготовка плазмы крови. Кровь здорового донора-добровольца была собрана в асептических условиях в стерильные пробирки с гепарином натрия и разделительным гелем («Группа Цзянсийких медицинских оборудований Хунда», Китай) объемом 5 мл, для получения составных центрифугировали при 3000 об./мин 5 минут (Eppendorf, Германия). Для активации использовали 10% раствор CaCl2. На каждый 1 мл крови добавляли 70 мкл 10% раствора CaCl2. Затем пробирка помещалась в термостат на 30 минут при 37°С для образования сгустка и центрифугировалась в течение 2 минут при 1500 об./мин (Eppendorf, Германия). Жидкая часть активированной плазмы была использована в дальнейших экспериментах.
1.3. Подготовка 3D-матрикса. Из коллагенового 3D-матрикса для регенерации мягких тканей Fibromatrix (Cardioplant, Россия) в асептических условиях были подготовлены пластины размером 9×9 мм.
1.4. Изучение цитотоксичности. Культуру ФЛЭЧ-104 1-3-го пассажей снимали с подложки, ресуспендировали в среде α-MEM (Gibco), содержащей 2% эмбриональной телячьей сыворотки (Biowest, Франция), 2 мМ L-глютамина и 40 ед/мл гентамицина, подсчитывали на автоматическом счетчике TC20 (BioRad, США) с окраской трипановым синим (0,4%) и рассевали по 15×103 клеток в 200 мкл среды на каждую лунку 48-луночного планшета c адгезивной поверхностью (Eppendorf, Германия). Предварительно во все экспериментальные лунки были помещены пластины коллагенового матрикса, лунки смачивались 200 мкл безклеточной культуральной средой.
Всего использовано 6 экспериментальных условий по 4 повтора для каждого:
1. Фиброматрикс для регенерации мягких тканей полости рта (контроль 1).
2. 3D-матрикс для восстановления мягких тканей ротовой полости и 10% активированной аутоплазмы донора.
3. FibroMatrix для регенерации мягкотканного покрова рта и 0,01% гиалуроната («Имплантат для стоматологии вязкоэластичный стерильный», Revident, Россия).
4. Адгезивная поверхность планшета (контроль 2).
5. Адгезивная поверхность планшета и 10% активированной аутогенной плазмы донора.
6. Адгезивная поверхность планшета и 0,01% гиалуроновой кислоты.
В качестве контрольных лунок использовали лунки без клеток с пластинами коллагенового 3D-матрикса Fibromatrix (Cardioplant, Россия) для регенерации мягких тканей полости рта и без него, содержащими 10% активированной плазмы донора или 0,01% гиалуроновой кислоты и без них.
Оценку цитотоксичности и пролиферативной активности проводили через 1, 3 и 7 суток с помощью МТТ-теста.
1.5. Проведение МТТ-теста. Колориметрический тест МТТ основан на способности оксидоредуктазов превращать желтый тетазолиевый краситель – 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид в нерастворимый пурпурный формазан. Через 1-7 дней среду удаляли и заменяли 400 мкл раствора МТТ 5 мг/мл на 4 часа. После чего вместо раствора МТТ добавляли 400 мкл диметилсульфоксида на 1 час для полного растворения образовавшихся кристаллов формазана. Затем по 200 мкл раствора переносили в лунки 96- луночного планшета (Eppendoux, Германия).
Оптическую плотность (ОП) полученного раствора регистрировали в каждой лунке при длине волны 530 нм и длине волны фонового поглощения 620 нм, используя мультипланшетный анализатор Spark 10M (Tecan, Австрия).
Анализ результатов МТТ-теста для каждой лунки рассчитывали ОПdif = ОП530 – ОП620. Относительная метаболическая активность клеток = ОПdif в лунке с активной плазмой или гиалуронатом – ОПdif соответствующей лунки без клеток/ ОПdif лунки только с коллагеновым матриксом или адгезивной поверхностью планшета – ОПdif соответствующей лунки без клеток * 100%. Все эксперименты проводили в четырех повторах, рассчитывали среднее значение для каждой серии повторов и стандартное отклонение.
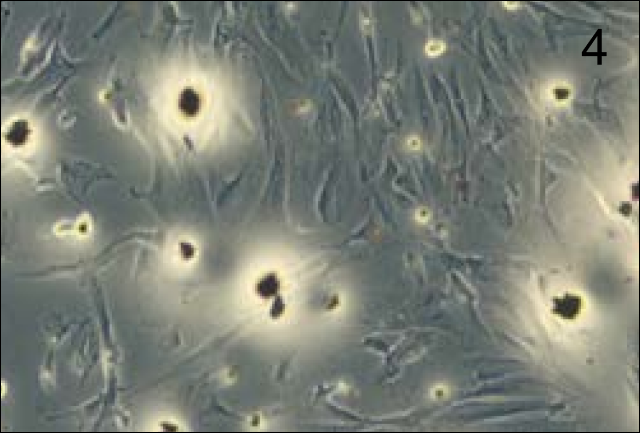
1.6. Микроскопическое исследование. Для регистрации полученных результатов клетки в отдельных подготовленных лунках для каждого из условий были фиксированы этанолом, окрашены красителем Гимза и сфотографированы в проходящем свете и/или с помощью метода фазового контраста на инвертированном микроскопе Axio Observer D1 и камеры AxioCam MRc5 (Carl Zeiss, Германия).
Статистическая обработка полученных результатов исследований проводилась с помощью программы GraphPadPrism v.6.0 с помощью параметрического критерия Стьюдента, уровень доверия – 95% (р <0,05).
Результаты и обсуждение
1. Оценка пролиферативной активности фибробластов человека в присутствии активированной плазмы или активированной плазмы на коллагеновом 3D-матриксе.
Активность пролиферации оценивали на 1-е, 3-и и 7-е сутки культивирования на экспериментальных материалах. Полученные результаты (рис. 1 и 2) показывают, что на первый день пролиферативная активность фибробластов достоверно ниже (р<0,0001), относительно контроля, в отличие от 3го и 7го дня в обоих случаях, причем максимальных стабильных равных значений она достигала в присутствии 3D-матрикса Fibromatrix на 3-и и 7-е сутки культивирования (р=0,3457). В то время, как в лунках без коллагена активность нормальных фибробластов не превышала 65% относительно контроля 2, причем результат на третий день был достоверно выше (р=0,0172), чем по окончании 1 недели культивирования.
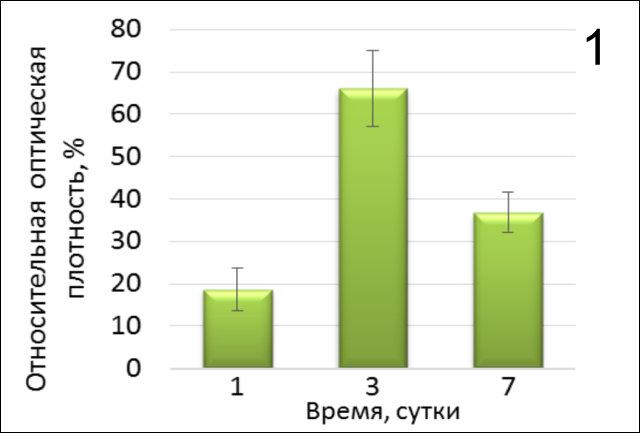
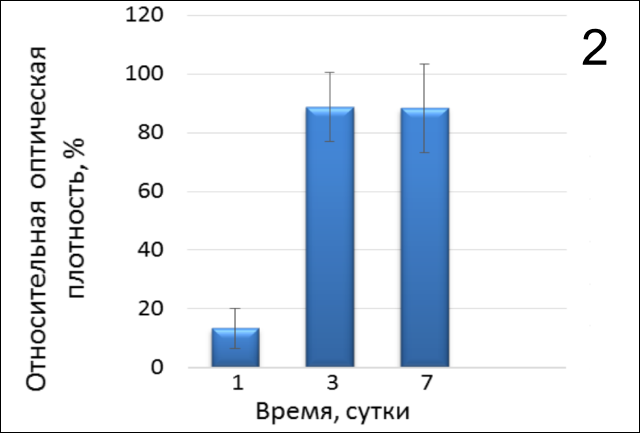
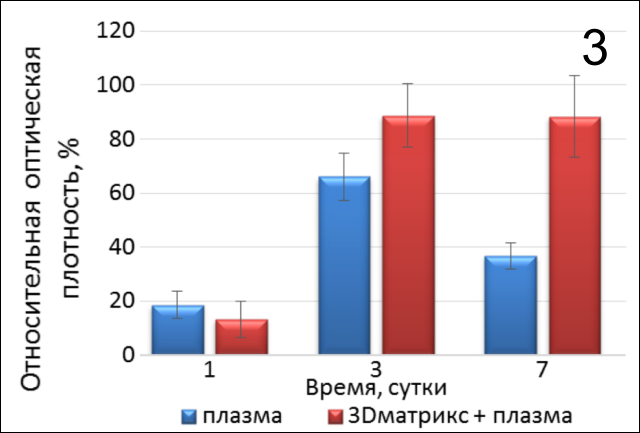
Таким образом, представленные данные (рис. 3) показывают, что при культивировании линии фибробластов ФЛЭЧ-104 на коллагеновом 3D-матриксе Fibromatrix в присутствии активированной плазмы наблюдается более высокая пролиферативная активность как на первые, так и на 7-е сутки (рис. 4,5).
2. Оценка пролиферативной активности фибробластов в присутствии препарата на основе гиалуроновой кислоты или препарата на основе гиалуронана на коллагеновом 3D-матриксе.
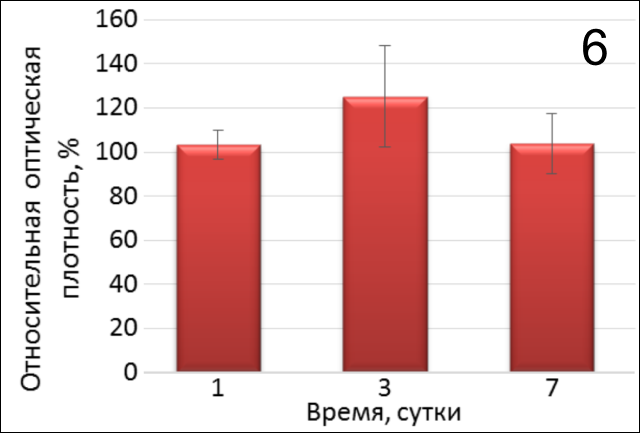
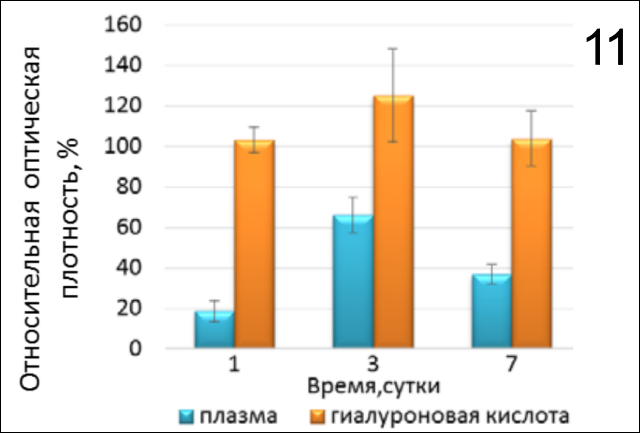
В присутствии только гиалуроновой кислоты (рис. 6) относительная активность клеточной пролиферации на 1й, 3й и 7ой день была практически одинакова (р=0,1858, р=0,9545, р=0,2357 соотв.) и не достигала 124% относительно контроля. Данные наблюдения позволяют сделать вывод о том, что гиалуронат способствует адгезии и пролиферации клеток, однако данный эффект незначителен относительно контроля 2.
Изучение пролиферативной активности клеточной культуры (рис. 7) показывает, что в лунках в присутствии гиалуроновой кислоты и мембраны Fibromatrix наиболее активный рост наблюдался только на 3-и сутки (р=0,0029, р=0,0008 соотв.). Кроме того, отмечен обратный, угнетающий эффект. Так, к седьмому дню культивирования в данных лунках показано значительное снижение (р=0,0008) клеточной пролиферации относительно контроля 2.
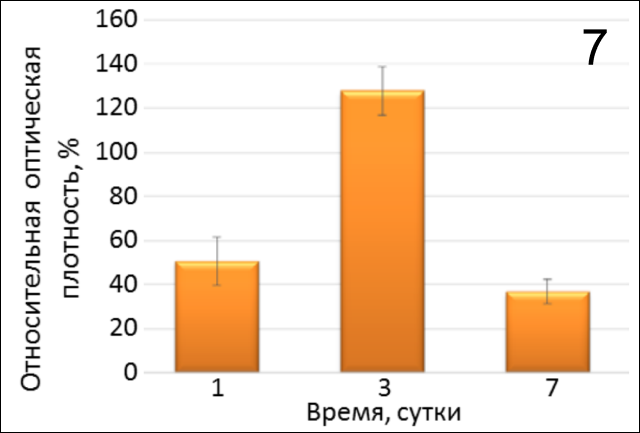
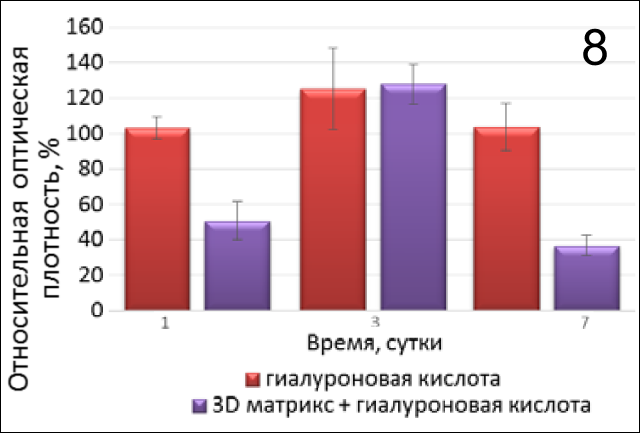
Таким образом, результаты эксперимента (рис. 8) показывают, что при сочетании гиалуроната с Fibromatrix пролиферация клеток на 1- и 7-е сутки значительно ниже (р=0,0020, р=0,0014 соотв.), чем в присутствии только гиалуроновой кислоты. Отмечено отрицательное влияние гиалуроновой кислоты на интенсивность деления и роста ФЛЭЧ-104 в лунках с 3D-матрицей Fibromatrix на 1 неделю (рис.9, 10).
3. Сравнительная оценка пролиферативной активности фибробластов с применением препаратов на основе гиалуроновой кислоты, активированной плазмы и коллагенового 3D-матрикса. При сравнительном анализе активности клеточных культур в лунках, содержащих только аутоплазму или гиалуронан (рис.11), установлено, что активированная плазма не создает условий для повышения пролиферативной активности фибробластов, а гиалуроновая кислота способствует росту клеток в незначительной степени относительно контроля 2.
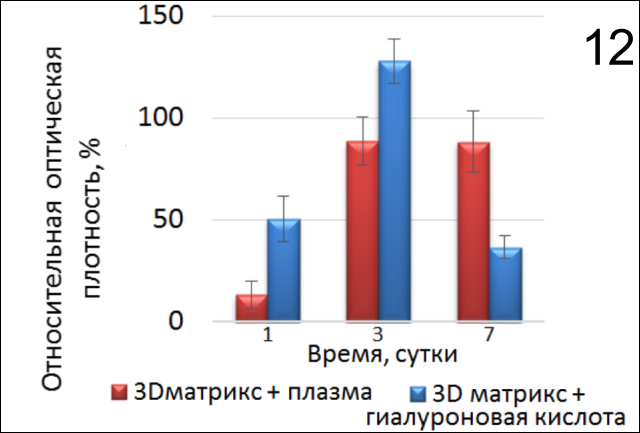
Однако в образцах, содержащих активизированную плазму и гиалуроновую кислоту в присутствии коллагенового 3D-матрикса Fibromatrix (рис. 12), плазма способствует адгезии и пролиферации клеток, а гиалуронат, напротив, подавляет клеточную активность к 7-м суткам (р=0,025, р=0,0180, р=0,0106, соотв.) (рис. 13, 14). Мы отметили ингибирующий эффект активной плазмы и образца Fibromatrix на ФЛЭЧ-104 на 1й день культивирования.


Результаты и обсуждение
В результате проведенного эксперимента получены данные о пролиферативной активности клеток фибробластоподобной линии из легких эмбриона человека ФЛЭЧ-104 в присутствии препарата на основе гиалуроновой кислоты Revident, активированной плазмы и коллагенового 3D-матрикса Fibromatrix. Результаты свидетельствуют о том, что наибольшая пролиферативная активность клеток наблюдалась в присутствии активированной плазмы и фрагмента Fibromatrix.
По данным исследований Долгалева А.А. с соавт. (2016, 2017) установлено, что использованный и в нашей работе фиброматрикс не обладает цитотоксичностью. Коллаген, входящий в состав мембраны Fibromatrix, обладает высокой плотностью и образует 3D-структуру, а значит, большее количество фибробластов может оседать на данной мембране. В работе Богдан В.Г. с соавт. (2014) установлено, что аутологичная тромбоцитарная плазма стимулирует синтез коллагена 1- и 3-го типов в культурах фибробластов и данными авторами сделан вывод о том, что синергичное увеличение продукции коллагенов с преимущественным накоплением коллагена 3-го типа может являться отражением активации фибробластов с формированием in vivo временной матрицы в процессе ремоделирования тканей в сочетании с преобразованием коллагена 3-го типа в истинный коллаген 1-го типа.
По данным исследований о составе тромбоцитарной аутоплазмы установлено, что она ускоряет естественные механизмы регенерации благодаря наличию в тромбоцитах факторов роста, которые активируют и стимулируют пролиферацию отдельных типов клеток. По результатам нашего эксперимента, положительный эффект активированной плазмы на пролиферативную активность фибробластов человека наблюдался на 3-и и 7-е сутки. Однако отмечен ингибирующий эффект на 1-е сутки, где активность клеток была значительно ниже относительно контроля. Возможно, это связано с тем, что в условиях in vitro наблюдается избыточная концентрация биологически активных молекул, подавляющих адгезию и деление фибробластов в первый день. Однако к 3-м суткам данный ингибирующий эффект нивелируется вследствие разрушения части молекул биологически активных веществ и усиления адаптации клеток.
Высокая пролиферативная активность фибробластов человека в присутствии активированной плазмы и 3Д-мембраны, очевидно, обусловлена тем, что помимо положительного влияния активированной плазмы на рост клеток обнаруживается положительное влияние и самой коллагеновой матрицы на адгезию клеток, что в свою очередь способствует повышению пролиферативной активности фибробластов.
Полученные нами результаты свидетельствуют о том, что гиалуроновая кислота способствует клеточной пролиферации, однако данный эффект незначителен. Более того, при оценке активности роста фибробластов человека в лунках с гиалуронатом и коллагеновым Фиброматриксом отмечен ингибирующий эффект к концу 1 недели культивирования.
В некоторых исследованиях показано, что гиалуроновая кислота определяет процессы регенерации мягких тканей: вызывает активизацию фибробластов, которые продуцируют коллагеновые волокна, стимулирует производство цитокинов фибробластами, кератиноцитами, цементобластами и стимулирует синтез эндогенной гиалуроновой кислоты эндотелиальными клетками. В работе Hammad H.M. (2011) показано, что гиалуронан участвует в процессах миграции и дифференцировке клеток.
В своем эксперименте мы использовали препарат на основе гиалуроновой кислоты Revident, содержащий высокомолекулярную ГК (до 3,3 мДа). В исследовании Gallorini M. с соавторами (2017), направленном на изучение влияния гиалуронатов на степень пролиферации и жизнеспособности клеток in vitro в зависимости от ее молекулярной массы, отмечено, что гиалуроновая кислота с высокой молекулярной массой (> 103 кДа) не влияет на пролиферацию. Помимо этого, некоторые авторы также отмечают ингибирующий эффект гиалуронана данного типа на клеточную пролиферацию.
Кроме того, полученные нами результаты могут быть обусловлены способностью гиалуроновой кислоты с высокой молекулярной массой повышать вязкость культуральной среды, что приводит к снижению пролиферативной активности фибробластов.
Для увеличения эффективности применения аутогенной тромбоцитарной плазмы с сочетанным использованием 3D-матрикса Fibromatrix для регенерации мягких тканей полости рта в клинической практике требуется подбор оптимальной концентрации тромбоцитарной аутоплазмы.
Выводы
При сравнительном анализе пролиферативной активности в присутствии матрицы Fibromatriх in vitro стабильный активный рост фибробластов наблюдался при сочетанном использовании Fibromatrix и активированной плазмы.
Препарат на основе высокомолекулярной гиалуроновой кислоты способствует пролиферации клеточной линии фибробластов человека, однако активность данного препарата снижается, ингибируя рост клеток уже к первой неделе.
Для оценки возможности увеличения пролиферативной активности в присутствии активированной плазмы и 3D-матрикса Fibromatrix необходимо провести подбор оптимальной концентрации аутоплазмы в ходе дальнейших исследований. Представленные результаты данного эксперимента in vitro демонстрируют перспективность применения комбинации аутогенной тромбоцитарной плазмы и аллогенного имплантата Fibromatrix для регенерации мягких тканей полости рта в клинической практике.

